El precio de un milagro. ¿Cuánto cuestan los tratamientos para la Atrofia Muscular Espinal?
Autor: José OlinPublicado: 2023-08-31
La Atrofia Muscular Espinal (AME) es la principal causa genética de muerte infantil, y hasta 2016 no había ningún tratamiento disponible. Actualmente existen tres medicamentos, sin embargo están clasificados entre los más caros del mundo y uno de ellos, Zolgensma, es el fármaco más caro de la historia, lo que ha generado polémica en torno al criterio de las farmacéuticas para fijar el precio de un medicamento, que de no aplicarse implica la muerte en los primeros dos años de vida, en los casos más comunes de AME.
Introducción
Nunca podrá caminar, es progresivo e incurable.
No recuerdo el diagnóstico exacto, pero recuerdo el resumen con 3 duras palabras: Nunca, progresivo e incurable.
Desde que tengo memoria era consciente de que la única forma de ralentizar el avance de la AME, era con terapia física. Interioricé que aceptar era la única forma madura de afrontarlo. No iba a bailar con Rosario (mi crush del jardín de niños) en el festival de primavera.
La madurez no debe ser lo mío, porque me llevó alrededor de 25 años aceptar mi discapacidad. Recuerdo que las primeras veces que investigué acerca de la AME y dispositivos de asistencia lo hacía a puerta cerrada, pues implicaba afrontar mi diferencia, la diferencia que evitó que bailara con Rosario y que me privó de la mayoría de las cosas que cualquier niño quiere hacer.
Aún creo que mi búsqueda de una vida autónoma es una muestra de que no lo acepto del todo, no si aceptar implica dejar de buscar una vida en la que podamos valernos por nosotros mismos.
A pesar de ser una condición considerada rara, afectando a 1 de cada 8,000 a 10,000 nacimientos, la AME es la principal causa genética de muerte infantil, por lo que desde 1984 se creó la Fundación CureSMA, para recaudar fondos para investigar qué la causaba y la búsqueda de una cura. De acuerdo a su página web, a la fecha han financiado subvenciones de investigación con más de $82 millones de dólares.
¿Qué causa la AME y cómo se manifiesta?
[...] los músculos se debilitan y eventualmente se atrofian, causando debilidad en las extremidades y al agravarse, dificultades para comer y respirar.
Eventualmente se descubrió que la AME es causada por mutaciones en un gen (SMN1), que proporciona instrucciones para producir una proteína (SMN) esencial para el funcionamiento de las neuronas motoras, que controlan el movimiento de brazos, piernas, cara, pecho, garganta y lengua.
Las mutaciones conducen a una producción escasa o nula de la proteína, lo que provoca la muerte de las neuronas motoras, por lo que los músculos se debilitan y eventualmente se atrofian [medline], causando debilidad en las extremidades y finalmente, dificultades para comer y respirar. La muerte debido a la AME suele ser por falla respiratoria.
Hay un gen de respaldo, el SMN2, que puede generar la proteína pero en menor cantidad. En tanto más copias haya del gen SMN2 más leves son los síntomas, por lo que existen varios tipos de AME; desde el tipo 0 (el más severo), que se manifiesta antes del nacimiento, hasta el tipo 4 (menos severo), cuyos síntomas empiezan en la vida adulta.
Los tipos más comunes son del 1 al 3. El tipo 1 es de los más severos, y el más común, representando aproximadamente la mitad de los casos. Los síntomas de AME 1 son aparentes en el nacimiento y se desarrollan durante los primeros 6 meses de vida. Sin tratamiento, la mayoría de niños con AME 1 no podrán sentarse sin ayuda y la mayoría no sobrevive más de 2 años.
Causas de la polémica
Con un precio de 2.1 millones de dólares por dosis única, Zolgensma es el fármaco más caro de todos los tiempos.
En 2016, treinta y dos años después de la fundación de la CureSMA, ocurrió el milagro; surgió Spinraza, el primer medicamento para tratar la AME. El ensayo clínico incluyó bebés recién nacidos y de hasta 7 meses, con AME tipo 1. Los resultados mostraban que el 41% de los bebés tratados con Sprinraza alcanzaron hitos de desarrollo motor (como caminar, pararse o rodar) que no alcanzó ninguno de los niños que recibieron un tratamiento placebo.
La noticia llenó de entusiasmo a la comunidad, había una esperanza; se estaba haciendo investigación y se tenía un tratamiento en vías de aprobación. Al día de hoy (2023) hay 3 tratamientos aprobados para la AME: Spinraza, Zolgensma y Evrysdi.
Pero, ¿dónde radica la polémica?
Precio de los tratamientos
Con un precio en EE. UU. de 2.1 millones de dólares por dosis única, Zolgensma es el fármaco más caro de todos los tiempos. Lo que inevitablemente genera algunas preguntas como ¿Con qué criterios está fijando el precio Novartis?
La pregunta se responde parcialmente al saber que Novartis no desarrolló Zolgensma, la compró por 8,700 millones de dólares a la empresa estadounidense AveXis, pero los costos de desarrollar el medicamento no son conocidos.
De acuerdo a swissinfo.ch "muchas compañías argumentan que los precios se calculan utilizando un modelo basado en el valor, lo cual plantea preguntas complicadas sobre cuánto vale una vida".
Zolgensma es un tratamiento génico y en principio, sólo se requiere una dosis; por lo que otro argumento para el precio es que una sola dosis de Zolgensma ahorraría una vida de los gastos asociados al cuidado y los tratamientos para frenar la condición.
Spinraza, otro de los tratamientos para la AME, que se debe administrar de por vida, tiene un precio de alrededor de 4 millones de dólares por década.
Por su parte, Spinraza, otro de los tratamientos para la AME que se debe administrar de por vida para mantener la producción de la proteína SMN, tiene un precio durante el primer año (fase de carga) de $750,000 dólares, y $350,000 dólares durante los años sucesivos, es decir, alrededor de 4 millones de dólares por década, aproximadamente 67 millones de pesos mexicanos.
El Instituto de Revisión Clínica y Económica (ICER), una agencia de investigación y vigilancia de fármacos, independiente y sin fines de lucro, emitió un reporte en abril de 2019 indicando que, aunque ambos habían ayudado sustancialmente a los niños que habían recibido cualquiera de los tratamientos, tenían precios excesivamente caros.
ICER recomendó que Spinraza debería costar entre $72,000 y $130,000 dólares el primer año de tratamiento, y de $36,000 a $65,000 en años subsiguientes, es decir, menos de una quinta parte del precio de venta actual.
La agencia tomó sus determinaciones utilizando una medida de la industria que valora cada "año de calidad de vida ajustada" ganado (QALY, por Quality-adjusted life year) entre $100,000 y $150,000 USD, aunque para enfermedades raras como la AME, los umbrales de $500,000 dólares por QALY no son infrecuentes.
El Dr. David Rind, director médico del ICER, agregó: "Desafortunadamente, con su precio actual, Spinraza supera con creces los umbrales comunes de rentabilidad. Entre las diversas empresas que ahora están lanzando terapias génicas al mercado, Novartis tiene aquí una oportunidad real de demostrar su liderazgo tanto científico como ético fijando el precio de lanzamiento de Zolgensma en consonancia con los beneficios que probablemente recibirán los pacientes".
La recomendación para Zolgensma era cobrar entre $310,000 y $900,000 dólares utilizando la medida estándar, y hasta 1.5 millones de dólares usando medidas alternativas de mejora de la salud. Muy por debajo de los 4 ó 5 millones que se proponía como precio potencial, y sustancialmente menor a los 2.1 millones en que actualmente se comercializa el tratamiento.
Sin embargo, en una actualización del reporte en mayo de 2019, después de aprobado Zolgensma por la FDA y al hacerse público el precio de venta, Steven Pearson, presidente de ICER, indicó que "Zolgensma está transformando drásticamente las vidas de las familias afectadas por esta devastadora enfermedad y, dados los nuevos datos de eficacia para la población presintomática, el precio anunciado hoy se encuentra dentro del límite superior del rango de referencia de precios basado en el valor de ICER".
Aunque Novartis propone permitir pagos a lo largo de cinco años, a razón de 425,000 dólares anuales, y hará reembolsos parciales si el tratamiento no funciona, la mayoría de los sistemas de seguros sanitarios no están diseñados para asumir tratamientos a esos precios.
Evrysdi, el más reciente de los tratamientos, tiene el mismo principio de funcionamiento de Spinraza, pero puede tomarse en casa, una vez al día; también debe administrarse de por vida para mantener la producción de la proteína. Tiene un precio fijado en un máximo de $340,000 USD al año, aprox. 5.7 millones de pesos mexicanos.
Para los que hace algún tiempo que pasamos el umbral de los dos años, Evrysdi parece la única opción; el único inconveniente es que necesitaríamos tener un sueldo de aproximadamente $500,000 pesos al mes para cubrirlo. Esto es, tener 7 trabajos de director de infraestructura aeroespacial; 13 trabajos de ingeniero electrónico; o 33 trabajos de profesor (mi ocupación anterior a Olin Robotics). Ni siquiera el sueldo del presidente de la república podría costear el tratamiento. Esa es la polémica.
Conclusiones
Escuchar por primera vez el precio de los tratamientos puede ser un ligero (o gran) golpe al hígado. Con todo y eso, la palabra incurable cada vez se desdibuja más del diagnóstico de la AME y se vislumbra un haz de esperanza antes invisible.
A pesar del derecho de las empresas a fijar los precios de sus productos, creo que debería tenerse una fuerte consideración de que las investigaciones fueron impulsadas y parcialmente financiadas por organizaciones sin fines de lucro, como la CureSMA.
Soy un privilegiado, mi AME es tipo II y la esperanza de vida es entre 20 y 40 años. Pero los niños con AME 1 no tienen este privilegio.
Ahora ejercito todas las mañanas con un objetivo, resistir hasta que los precios bajen o nos ganemos la lotería; resistir hasta que ocurra el verdadero milagro, la humanidad anteponiendo la humanidad a la ganancia.
Apéndices
Detalles de los Tratamientos para la AME
En la siguiente figura se muestra un resumen de sus estrategias terapéuticas y métodos de administración de los tratamientos para AME.
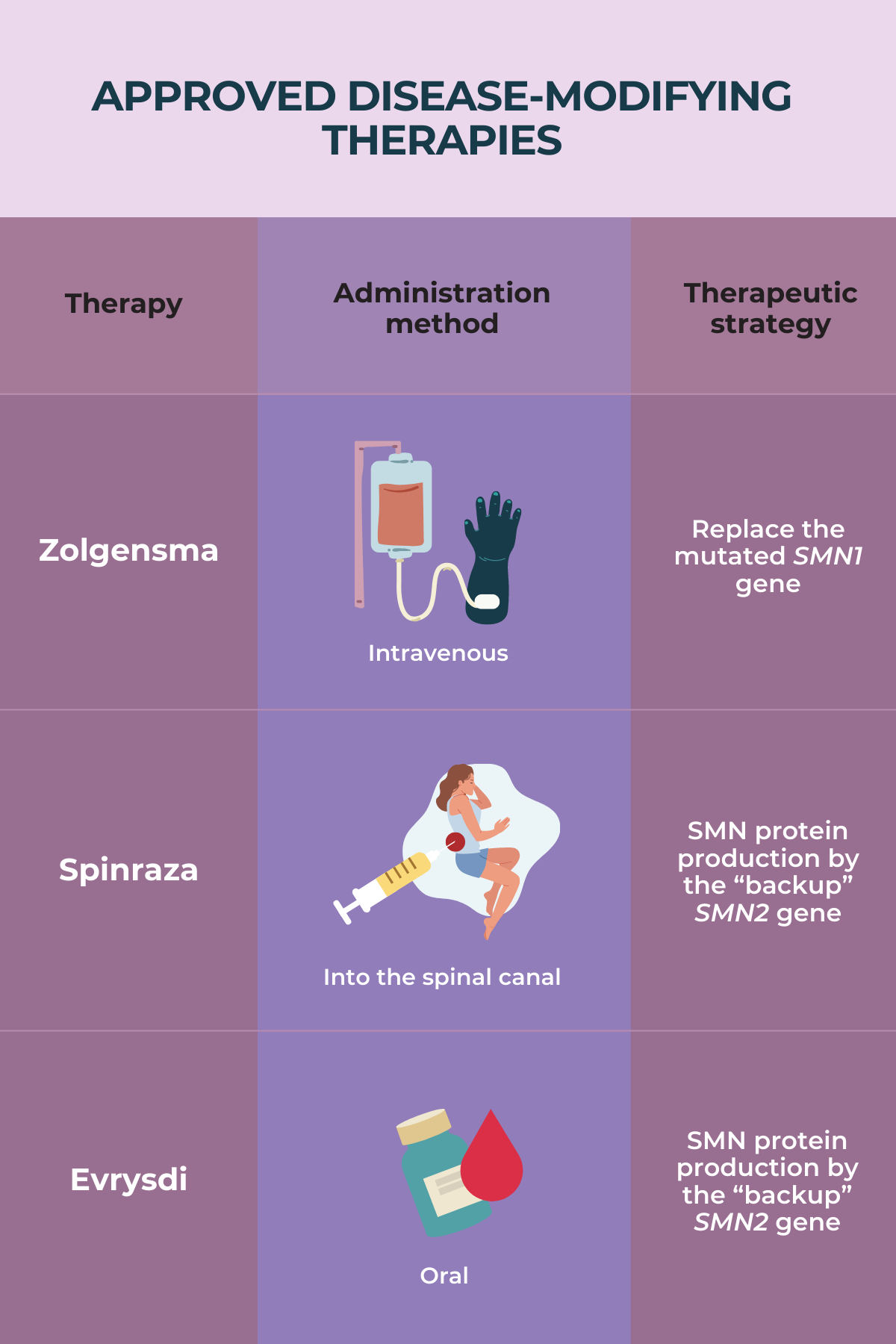
Spinraza (nusinersen) de Biogen
Spinraza es un oligonucleótido antisentido (ASO, por Antisense oligonucleotide), una molécula diseñada para aumentar los niveles de la proteína SMN, al unirse a la molécula de respaldo SMN2. Fue Aprobado por la FDA en diciembre de 2016 para tratar niños y adultos.
Los ASO son demasiado grandes para cruzar la barrera hematoencefálica, que evita que microorganismos dañinos lleguen al cerebro. Por lo tanto la terapia se administra directamente en el canal espinal, con una dosis recomendada de 12 mg independientemente de la edad o el peso.
Después de una fase inicial intensiva con 3 aplicaciones cada dos semanas y una cuarta un mes después, Spinraza se aplica cada 4 meses en centros con personal capacitado para realizar punciones lumbares.
En el reporte de ICER de abril de 2019 acerca de los tratamientos para la AME, anotaban que "Debido a que la AME es una efermedad rara y los ensayos tienen un seguimiento a corto plazo, comprender los efectos a largo plazo de Spinraza o Zolgensma llevará tiempo. Para Spinraza, existe incertidumbre sobre los efectos de las punciones lumbares repetidas, particularmente a medida que los pacientes envejecen o progresan durante el curso de la enfermedad".
Zolgensma de Novartis
Es la primera terapia génica aprobada para AME, que busca reparar los genes para que sean capaces de producir esas proteínas en cantidades normales.
Zolgensma utiliza un virus adenoasociado serotipo 9 (AAV9) inofensivo y diseñado genéticamente para entregar una copia funcional de SMN1 a las células del cuerpo. El gen entregado consta de ADN de doble cadena, lo que significa que toma la misma forma que los genes naturales y puede activarse rápidamente una vez dentro de la célula. Con este gen en funcionamiento, las neuronas motoras y otras células pueden producir proteína SMN funcional [Zolgensma].
Es una terapia de una sola aplicación por vía intravenosa que dura aproximadamente una hora. Fue aprobada por la FDA en mayo de 2019, y es recién la segunda terapia génica aprobada por la FDA, después de Luxturna, aprovada para la distrofia retinal hereditaria.
En el reporte de ICER de abril de 2019, se mencionaba acerca de Zolgensma que no se sabe durante cuánto tiempo la terapia génica puede proporcionar beneficios a los pacientes con AME, advirtiendo que si se forman anticuerpos contra el AAV (virus adenoasociado), el paciente no podrá recibir otra dosis de Zolgensma.
Evrysdi (risdiplam) de Genentech (Roche)
Es el primer tratamiento oral y casero aprobado para todos los tipos de AME. Desarrollado por Genentech, una subsidiaria de Roche, en colaboración con la SMA Foundation. Fue Aprobado por la FDA en agosto de 2020.
Es un líquido saborizado que se toma una vez al día, por vía oral o mediante sonda de alimentación. Tiene una molécula diseñada para aumentar la producción de proteína SMN funcional, mediante el gen de respaldo SMN2, que en condiciones normales solo puede producir hasta el 15% de SMN funcional [Evrysdi].
La molécula es suficientemente pequeña para atravesar la barrera hemotoencefálica y llegar al cerebro y la médula espinal.
En EE. UU., está disponible para pacientes de todas las edades; en otras regiones está limitado a mayores de 2 meses.
Estudios de la Efectividad del Evrysdi
Los estudios realizados con Evrysdi incluyeron niños de 1 a 8 meses y niños y adultos de entre 2 y 25 años. Mostrando aumentos en la función motora más pronunciados en los pacientes más jóvenes (2 a 5 años) que en los mayores (18-25) Ineuro.
En los pacientes más jóvenes se observó una ganancia de 3 o más puntos en la escala de la Medida de Función Motora-32 (MFM32) en el 78,1% de los tratados con Evrysdi y en el 52,9% de los que recibieron un placebo. Mientraas que en los pacientes mayores el 57.1% mostró estabilización de sus capacidades motoras, en comparación con el 37.5% de grupo placebo.




